药物临床试验机构
一、基本情况
999.8vnsr威尼斯人国家药物临床试验机构(以下简称“机构”)
自2012年3月启动创建国家药物临床试验机构工作,并于2013年1月通过国家食品药品监督管理总局现场核查,颁发国家药物临床试验机构资格认定证书,开设四个专业。2020年12月按照国家药品监督管理局文件要求机构重新完成药物临床试验机构备案同时增设两个新专业,目前备案专业共计6个。现有专业分别为:呼吸专业、神经外科专业、心血管专业、肿瘤专业、消化专业、内分泌专业。机构设施设备齐全,能满足药物临床试验日常管理工作需要,设有档案室、GCP药房(筹建中)等专用场所。
机构制定较为完善的管理制度及SOP,现有机构通用制度,职责、设计规范、标准操作规程等文件。各专业制定相关专业的标准操作规程。内容涵盖临床管理、实施等各方面,能满足临床试验实施的需要。
目前,医院已有百余名医护、技人员接受过临床试验相关法规的国家培训,医院具有完备的临床新药科研基础设施和技术条件,重视质量管理,能够保证试验过程的规范性操作,确保项目顺利实施,逐步建立成为高水平、高质量且能与国际接轨的药物临床试验研究平台。
随着不断完善的管理制度以及管理团队,本机构提供服务、监管、协调、培训等职能的管理模式,竭力为申办者、研究者提供高效的质量管理,保证试验过程的规范,试验结果的真实可靠,保障受试者的权益。
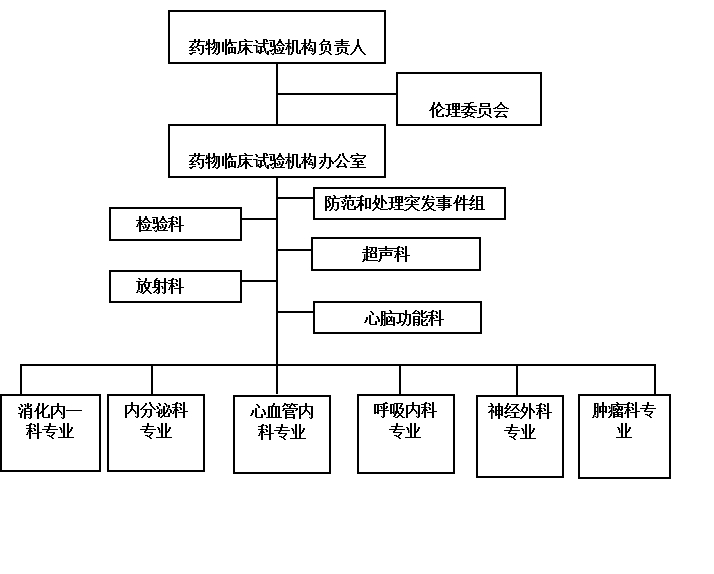
二、机构设置
药物临床试验机构组织结构图
三、临床试验项目开展的工作流程
1、项目初审
(1)申办方将临床试验方案发至机构办邮箱或递交纸质版到机构办,由机构审核方案后反馈至申办方。
(2)如项目不存在重复或类似,申办方需填写《立项申请表》签名后发送扫描件至机构办邮箱,同时发送项目相关资料。
(3) 伦理审查
请参照本院伦理委员会章程,或详情咨询本院伦理委员会。
(4)签署合同
1.联系机构办进行合同的洽谈签署等工作。
2.申办方按照《项目申请资料清单》准备纸质版资料并盖章后交至机构办,用于存档备案。
(5)物资交接
协议签署,首付款到位后监查员联系机构和研究科室做好试验用药品及物资的交接并做好记录。
(6)关于监查员备案
1.参与本中心监查的监查员需携带个人资料(包括公司委托书原件、简历,GCP证书、学历证书复印件等相关资料)至机构办签署《监查员知情同意书》完成监查员备案。
2.未进行监查员备案的的人员一律不准在本中心做相关的监查工作。
(7)项目启动
由项目相关人员(研究者及相关工作人员等)对方案进行培训。
(8)项目进行中
监查员需按照机构办公室要求在本中心进行监查工作。
(9)项目结题、总结盖章
1.项目结题之前需提前预约机构质控员完成项目质控;
2.项目结题前需将本中心的款项结清;
3.按照《药物临床试验归档目录》的要求完成资料归档;
4.项目小结、总结资料需完成本机构的审核后方可盖章。
工作时间:周一至周五上午08:00-12:00,下午14:30-17:30
机构联系电话:0898-88021050
机构联系人:莫薇薇
邮箱:Pandapanda2013@126.com
机构地址:海南省三亚市天涯区解放三路558号999.8vnsr威尼斯人内科楼5楼
